
自2015年7月22日CFDA发布《国家食品药品监督管理总局关于开展药物临床试验数据自查核查工作的公告》以来,CFDA启动了一些列的核查并公布了对违规企业、CRO、医院、研究者的处罚措施。凸显了在习主席的领导下药监管理思路的改革,即以最严厉的监管来开展药物临床试验。随着系列公告的颁布,严厉的监管对申办企业起到了震慑。据统计,已有1300余个品种撤回申报。
为加强我院研究者对这次风暴的认识,提高对临床试验风险和收益比,认真贯彻执行GCP,保护受试者,保障质量,协助企业高水准完成临床试验,并且避免因临床试验的不真实、不规范、不完整等问题给医院和专业带来一定的风险,给个人声誉带来不利的影响。2016年7月11日下午,在教学楼阶段教室科研处药物临床试验机构办公室面向全院召开了主题为《药物临床试验核查风暴解读及药物临床试验责任承担》的会议。会议邀请了国家药监局食品药品审核查验中心的核查专家,与我们分享药物临床试验监管、核查的方法和思路。姚院长在会前分析了当前形势,对我院提出了更高的要求:期望大家通过学习,认识到风险,做好PI责任承担,切实有效地提高我院药物临床试验工作的水平,使我院临床试验能够在充分保障受试者权益的基础上合法、合规、真实、完整。更好地迎接各上级部门和单位的检查。机构办公室王清就我院临床试验核查情况及时通报了与会人员。
会议共有13个专业的部分主任,大部分专业秘书,及一些开展医疗器械和试剂研究的主任,研究者共计30余人参会。希望借助此次会议,我院的PI及团队能在研究者承担责任的这个高度下开展临床试验,促进和带动我院药物临床试验整体水平的提高,更好地通过CFDA的复核审核,促进我院学科的建设和发展。
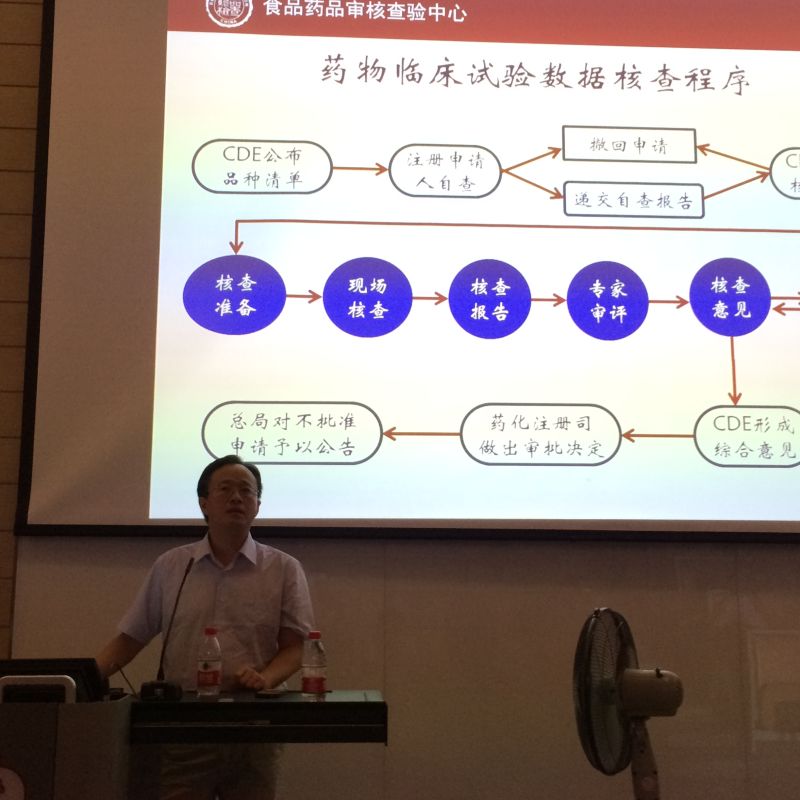
CFDA审核查验中心高博士讲解政策法规核查要点